|
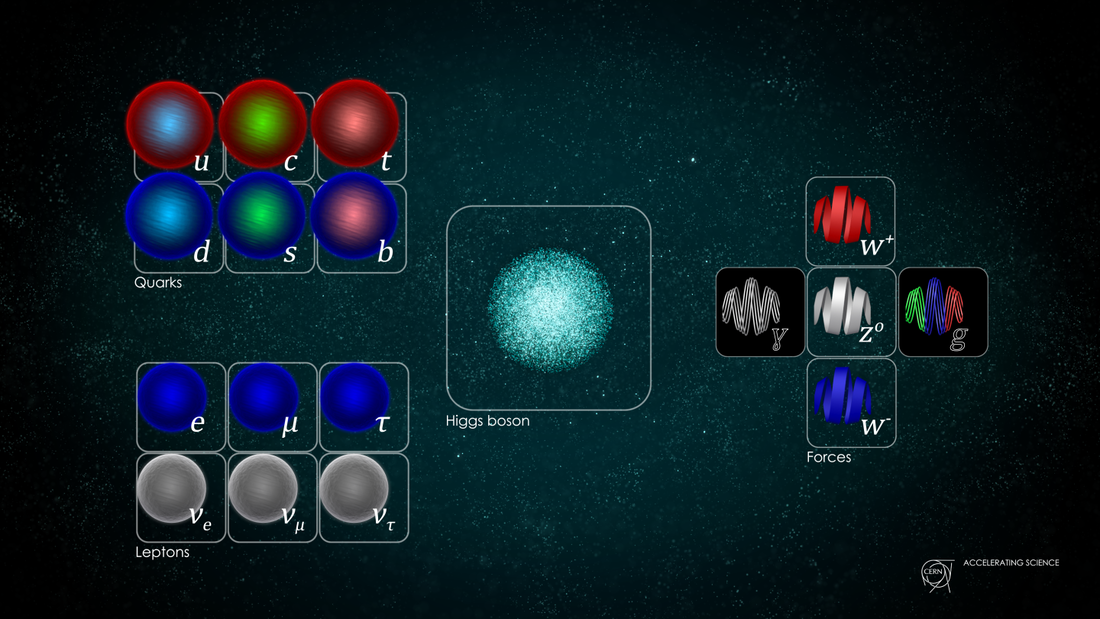
Του Γιώργου Μελαχροινού Εικόνα 1. Ο πίνακας στοιχειωδών σωματιδίων του καθιερωμένου προτύπου (image credit: CERN) Το παρόν αποτελεί ένα πρώτο εισαγωγικό άρθρο σε μία σειρά άρθρων που θα ακολουθήσουν στα επόμενα τεύχη του Περιοδικού με θέμα τη φυσική των υψηλών ενεργειών και των στοιχειωδών σωματιδίων. Σκοπός των άρθρων είναι να παρουσιαστούν με όσο το δυνατόν απλό, περιεκτικό αλλά και κατανοητό τρόπο όχι μόνο οι θεωρητικές πτυχές της θεωρίας που περιγράφει σε εντυπωσιακή συμφωνία με τα πειραματικά δεδομένα τα φαινόμενα της σωματιδιακής φυσικής, που ονομάζεται Καθιερωμένο Πρότυπο, αλλά και οι πειραματικές έρευνες που γίνονται σε διεθνές επίπεδο σε ευρωπαϊκά και όχι μόνο ερευνητικά κέντρα. Τέλος, θα γίνονται αναφορές σε βιβλία και άρθρα τα οποία θα βοηθήσουν τον αναγνώστη να φτάσει πιο βαθειά στην κατανόηση της φύσης και θα γίνουν αναφορές σε θεωρίες που θα μπορούσαν να συμπληρώσουν τη θεωρία του Καθιερωμένου Προτύπου. Για αιώνες, η ατομική θεωρία, δηλαδή η θεωρία που υποστηρίζει ότι η ύλη αποτελείται από στοιχειώδη και αδιάσπαστα σωμάτια, τα άτομα (1), που προτάθηκε πρώτη φορά από τον Δημόκριτο, παρέμεινε αδρανής. Περί το 1800 μ.Χ. ο John Dalton επανέφερε στο προσκήνιο τη συγκεκριμένη θεωρία και τη βελτίωσε για να μελετήσει και να κατανοήσει τα αποτελέσματα των χημικών του πειραμάτων, θέτοντας επιπλέον μερικές αρχές οι οποίες θα πρέπει να ισχύουν και να μην παραβιάζονται από τα χημικά φαινόμενα που μελετούσε (2). Εν συντομία η θεωρία του περιγράφεται ως εξής:
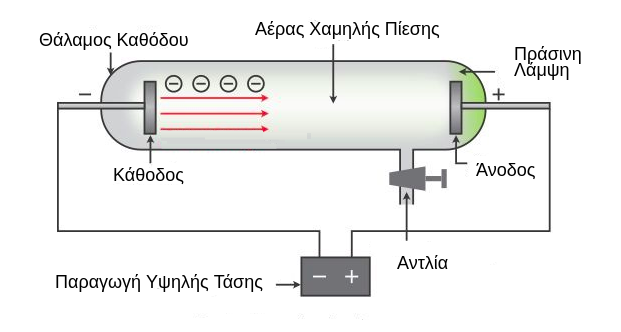
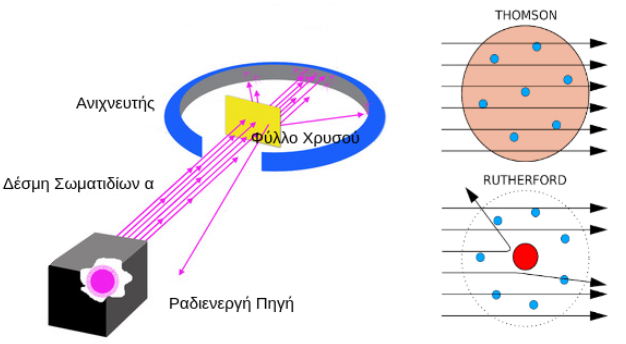
Σχεδόν εκατό χρόνια αργότερα από τον Dalton, και ενώ οι εικασίες για την ύπαρξη υποατομικών σωματιδίων είχαν αρχίσει να πληθαίνουν, το 1897 ο J.J. Thomson, μελετώντας σωλήνες καθόδου (Εικόνα 2), ήρθε αντιμέτωπος με την ανακάλυψη του πρώτου στοιχειώδους σωματιδίου. Ως σωλήνες καθόδου χρησιμοποιούσε γυάλινους σωλήνες τους οποίους άδειαζε από αέρα με τη βοήθεια αντλίας. Στα άκρα τους εφάρμοζε διαφορά δυναμικού χρησιμοποιώντας δυο σύρματα, τα ηλεκτρόδια(2). Παρατήρησε τότε ότι από το ηλεκτρόδιο αρνητικής τάσης, την κάθοδο, εκπεμπόταν πλήθος σωματιδίων τα οποία κατευθυνόταν προς το ηλεκτρόδιο θετικής τάσης, την άνοδο, τα οποία όταν έπεφταν στο γυαλί πίσω από την άνοδο δημιουργούσαν μια πράσινη λάμψη. Τα σωμάτια αυτά ονομάστηκαν ηλεκτρόνια. 1 Από το α(στερητικό)+τέμνω (κόβω, χωρίζω, διαιρώ) 2 Για περισσότερες πληροφορίες μπορεί να ανατρέξει κανείς στα σχολικά βιβλία της Φυσικής και της Χημείας του Γυμνασίου και του Λυκείου, μερικά από τα οποία υπάρχουν στις αναφορές του παρόντος άρθρου. 3 Kάθε άτομο χαρακτηρίζεται από δύο αριθμούς, τον ατομικό που είναι χαρακτηριστικός του στοιχείου και είναι ίσος με τον αριθμό των πρωτονίων-ηλεκτρονίων και τον μαζικό αριθμό που είναι το άθροισμα του αριθμού των νετρονίων και των πρωτονίων και είναι διαφορετικός ακόμα και για άτομα του ίδιου στοιχείου δημιουργώντας έτσι τον ισοτοπικό χάρτη. Εικόνα 2. Σωλήνας καθόδου (πηγή) Τα πειράματα που ακολούθησαν τα επόμενα χρόνια οδήγησαν στην μέτρηση του φορτίου, της μάζας και τη μελέτη των υπόλοιπων χαρακτηριστικών αυτών των σωματιδίων. Ο Thomson πρότεινε μάλιστα το 1904 το μοντέλο του σταφιδόψωμου για να περιγράψει τη δομή των ατόμων. Σύμφωνα με το μοντέλο αυτό, τα άτομα αποτελούνται από μια σφαίρα, η οποία είναι θετικά φορτισμένη, και μέσα σε αυτήν την σφαίρα είναι διασκορπισμένα τα αρνητικά φορτισμένα ηλεκτρόνια όπως περίπου είναι και οι σταφίδες σε ένα σταφιδόψωμο. Θα πρέπει ωστόσο τα ηλεκτρόνια να είναι τόσα στον αριθμό ώστε το συνολικό φορτίο του ατόμου να είναι μηδέν. Λίγα χρόνια αργότερα, το 1909, ο Rutherford κάνοντας το παρακάτω πείραμα απέρριψε την θεωρία του σταφιδόψωμου και ανακάλυψε τον πυρήνα, την περιοχή δηλαδή στο εσωτερικό του ατόμου που είναι συγκεντρωμένο το θετικό φορτίο του. Στα πειράματα του ο Thomson παρατήρησε ότι τα σωματίδια-α (πυρήνες Ηλίου) τα οποία εκπέμπονταν από ραδιενεργές πηγές όταν έπεφταν επάνω σε φύλλα χρυσού σκεδάζονταν, άλλαζαν δηλαδή πορεία σε σχέση με την αρχική τους κατεύθυνση με τρόπο που δεν μπορούσε να εξηγηθεί από την κατανομή των ηλεκτρονίων μέσα στο θετικό φορτίο όπως προέβλεπε το πρότυπο του σταφιδόψωμου. Αντίθετα θα πρέπει το θετικό φορτίο του ατόμου, το οποίο αποτελείται από μικρά σωματίδια που ονομάζονται πρωτόνια και έχουν κατά μέτρο όσο φορτίο έχουν και τα ηλεκτρόνια, να είναι συγκεντρωμένο στο κέντρο του, σχηματίζοντας μια περιοχή που ονομάζεται πυρήνας, και γύρω απ’ αυτήν την περιοχή θα πρέπει να περιφέρονται τα ηλεκτρόνια όπως περιφέρονται και οι πλανήτες γύρω από τον Ήλιο. Θα πρέπει επίσης τα πρωτόνια, προκειμένου το άτομο να είναι ηλεκτρικά ουδέτερο, να είναι στο πλήθος όσα είναι τα ηλεκτρόνια. Ο Rutherford επίσης είπε ότι το μεγαλύτερο ποσοστό της μάζας του ατόμου είναι συγκεντρωμένο στον πυρήνα και πώς ο μεγαλύτερος όγκος που καταλαμβάνει το άτομο είναι κενός. Περισσότερες λεπτομέρειες για την σκέδαση Rutherford θα δοθούν σε επόμενο άρθρο του περιοδικού όπου θα μιλήσουμε για ελαστικές σκεδάσεις ηλεκτρονίων – πρωτονίων. Μέχρι τότε, ο αναγνώστης μπορεί να δει τον παρακάτω υπερσύνδεσμο. Εικόνα 3. Αριστερά: η διάταξη του πειράματος του Rutherford. Δεξιά: Ο τρόπος που θα έπρεπε να σκεδάζονται τα σωματίδια -α ανάλογα με το μοντέλο της δομής του ατόμου. Το μοντέλο του Thomson δεν μπορούσε να εξηγήσει το γεγονός ότι σωμάτια α σκεδάζονται σε μεγάλες γωνίες ή ακόμα και το ότι οπισθοσκεδάζονται καθώς σύμφωνα με το πρότυπο του σταφιδόψωμου η τυχαία κατανομή των ηλεκτρονίων στο εσωτερικό του ατόμου θα είχε ως αποτέλεσμα τα σωμάτια α να μην σκεδάζονται σε μεγάλες γωνίες, πόσο μάλιστα να οπισθοσκεδάζονται και να καταγράφονται πάνω στις φθορίζουσες επιφάνειες που λειτουργούν ως ανιχνευτές. (Πηγή) Ωστόσο πολύ σύντομα προέκυψαν προβλήματα και με αυτή την θεωρία καθώς δεν μπορούσε να εξηγήσει την ευστάθεια του ατόμου. Σύμφωνα με την θεωρία του κλασικού Ηλεκτρομαγνητισμού δυο σωμάτια αντίθετου φορτίου έλκονται και έτσι τα ηλεκτρόνια θα έπρεπε καθώς περιφέρονται γύρω από τον πυρήνα και επιταχύνονται να εκπέμπουν ενέργεια με την μορφή ακτινοβολίας. Έτσι θα πρέπει να διαγράφουν σπειροειδή τροχιά και να πέφτουν επάνω στον πυρήνα. Δηλαδή μια τέτοια υπόθεση για την δομή του ατόμου δεν μπορούσε να εξηγήσει την ίδια του την ευστάθεια. Επίσης παρατήρησαν ότι μια τέτοια θεωρία για την δομή των ατόμων δεν μπορούσε να εξηγήσει τα γραμμικά φάσματα εκπομπής των αερίων. Σύμφωνα με τη συγκεκριμένη θεωρία, τα ηλεκτρόνια καθώς επιταχύνονται και κατευθύνονται στον πυρήνα θα πρέπει να χάνουν ενέργεια με τρόπο συνεχή που θα υπακούει στον τύπο του Larmor σύμφωνα με τον οποίο όταν ένα φορτισμένο σωματίδιο (όπως είναι και το ηλεκτρόνιο) επιταχύνεται, ακτινοβολεί ενέργεια με την μορφή ηλεκτρομαγνητικών κυμάτων και μάλιστα η ισχύς της ακτινοβολίας είναι ανάλογη του τετραγώνου του φορτίου του και του τετραγώνου της επιτάχυνσής του. Κάτι τέτοιο όμως ερχόταν σε πλήρη αντίθεση με τις διακριτές φωτεινές γραμμές που παρατηρούσαν κατά την αποδιέγερση αερίων. Επιπλέον παρατήρησαν ότι υπήρχε αναντιστοιχία και με την μάζα των πυρήνων καθώς τα μέχρι τότε γνωστά συστατικά τους δεν μπορούσαν να εξηγήσουν το γεγονός ότι η μάζα του πυρήνα είναι περίπου διπλάσια από την μάζα των πρωτονίων. Έτσι ο Rutherford υπέθεσε ότι θα πρέπει να υπάρχει μια κατάσταση η οποία θα είναι ζεύγος πρωτονίου-ηλεκτρονίου ώστε η κατάσταση αυτή να μην έχει φορτίο και η μάζα του θα πρέπει να είναι σχεδόν ίδια με την μάζα του πρωτονίου ώστε να μπορούν να εξηγηθούν οι μέχρι τότε παρατηρήσεις. Το έργο της ανακάλυψης αυτού του ζεύγους έφερε εις πέρας ο Chadwick. Το 1930 παρατηρήθηκε πως όταν το βηρύλλιο βομβαρδιστεί από σωματίδια-α, τότε εκπέμπεται ενεργητική και εξαιρετικά διεισδυτική ακτινοβολία η οποία είναι ουδέτερη καθώς δεν εκτρέπεται από μαγνητικά πεδία. Επίσης παρατήρησαν πως όταν η ακτινοβολία αυτή πέσει επάνω σε στόχο που είναι πλούσιος σε πρωτόνια, όπως είναι η παραφίνη, τότε πλήθος πρωτονίων εκπέμπονται από τον στόχο. Το 1932, ο Chadwick πρότεινε ότι αυτή η ακτινοβολία αποτελείται από ένα νέο σωματίδιο το οποίο ονομάστηκε νετρόνιο. Χρησιμοποιώντας μάλιστα την κινηματική της αντίδρασης που μελετούσε απέδειξε ότι η μάζα των σωματιδίων αυτής της νέας ακτινοβολίας είναι σχεδόν ίδια με αυτήν του πρωτονίου. Το 1935, ο Chadwick τιμήθηκε με το βραβείο Νόμπελ για αυτήν του την ανακάλυψη. Η ανακάλυψη αυτή και η δημοσίευσή της οδήγησε στον Heisenberg να μιλήσει για το μοντέλο του πρωτονίου-νετρονίου για την δομή του πυρήνα. Εικόνα 4. Από αριστερά ο James Chadwick (nobel 1935), μαθητής του Ernest Rutherford (nobel 1908). Βέβαια και πάλι η ιστορία δεν τελειώνει εδώ. Η υπόθεση ότι το νετρόνιο ήταν ζεύγος πρωτονίου–ηλεκτρονίου αποδείχθηκε εσφαλμένη καθώς αυτό θα υπέθετε ότι στον πυρήνα υπήρχαν ηλεκτρόνια κάτι που δεν μπορούσε να εξηγηθεί από τα πειραματικά δεδομένα. Άρα πρόκειται για ένα εντελώς νέο σωματίδιο. Πολύ σύντομα ανακάλυψαν πως το καινούριο σωματίδιο όταν είναι ελεύθερο και δεν βρίσκεται μέσα σε πυρήνα, είναι ασταθές και μετά από κατά μέσο όρο 15 περίπου λεπτών διασπάται. Το ακόμα πιο περίεργο είναι ότι αν το νετρόνιο διασπάται σε ένα πρωτόνιο και ένα ηλεκτρόνιο (όπως θα πρέπει τουλάχιστον να γίνεται προκειμένου να διατηρείται το ηλεκτρικό φορτίο) θα πρέπει και τα δύο σωματίδια-προϊόντα της αντίδρασης να έχουν καλά καθορισμένες ενέργειες και ορμές. Μπορεί να δει κανείς ότι αν έχει ένα σωμάτιο Α το οποίο διασπάται στα σωμάτια Β και Γ, στο σύστημα κέντρου μάζας του μητρικού σωματιδίου οι ενέργειες των παραγόμενων σωματιδίων θα πρέπει να είναι ίσες με: \[EB=\frac{{m_A}^2+{m_B}^2-{m_\Gamma }^2}{2mA}\cdot c^2, \; \; E\Gamma =\frac{{m_A}^2+{m_\Gamma B}^2-{m_B }^2}{2mA}\cdot c^2,\] όπου c η ταχύτητα του φωτός και m η μάζα του εκάστοτε σωματιδίου. Δηλαδή, στο πλαίσιο ενός πειράματος η μέτρηση της ενέργειας του ηλεκτρονίου θα πρέπει να δώσει μία γκαουσιανή κατανομή με κέντρο κοντά στην τιμή: \[Ee =\frac{{m_n}^{2}+{m_e }^2-{m_p }^2}{2mn}\cdot c^2\] όπου e: ηλεκτρόνιο, n: νετρόνιο, p: πρωτόνιο. Το για ποιο λόγο θα προκύψει μια γκαουσιανή κατανομή ύστερα από επαναλαμβανόμενες μετρήσεις της ενέργειας των ηλεκτρονίων που προέρχονται από την συγκεκριμένη διάσπαση θα συζητηθεί επίσης σε επόμενο άρθρο. Στην πραγματικότητα όμως οι επαναλαμβανόμενες μετρήσεις δεν φανέρωσαν μία τέτοια κατανομή αλλά ένα συνεχές φάσμα από το μηδέν έως και μία μέγιστη τιμή. Iδιαίτερα χρήσιμος είναι και ο ακόλουθος υπερσύνδεσμος στον οποίο φαίνεται και η πραγματική κατανομή της ενέργειας του ηλεκτρονίου. Το συνεχές φάσμα υποδηλώνει το ότι το ηλεκτρόνιο δεν έχει καλά καθορισμένη ορμή και συνεπώς ότι το νετρόνιο δεν διασπάται σε πρωτόνιο και ηλεκτρόνιο και έτσι η συγκεκριμένη παρατήρηση έρχεται σε πλήρη αντίθεση με την αρχική υπόθεση ότι δηλαδή το ελεύθερο νετρόνιο διασπάται σε δύο σωματίδια. Το συνεχές φάσμα υποδηλώνει ότι κάθε φορά υπάρχει κάποια ποσότητα ενέργειας και ορμής που δεν μπορεί να μετρηθεί. Το 1930 λοιπόν ο Wolfgang Pauli πρότεινε την ύπαρξη ενός τρίτου σωματιδίου το οποίο θα πρέπει να μην έχει φορτίο ώστε πρώτον να μην παραβιάζεται στην αντίδραση η αρχή διατήρησης του ηλεκτρικού φορτίου και δεύτερον για να μην αλληλεπιδρά και ανιχνεύεται από τους ανιχνευτές όπως το ηλεκτρόνιο ενώ τέλος θα είναι και το σωμάτιο που θα φέρει την χαμένη ορμή και ενέργεια. Αυτό το σωματίδιο ονομάστηκε (επειδή είχε μερικά όμοια χαρακτηριστικά με εκείνα του νετρονίου όπως είναι η ηλεκτρική ουδετερότητα) νετρίνο. Η διάσπαση αυτή των νετρονίων ονομάστηκε β–διάσπαση καθώς ανιχνευόταν το ηλεκτρόνιο το οποίο συμβολιζόταν συχνά και ως β– σωμάτιο. Στο επόμενο άρθρο θα λύσουμε τα προβλήματα που έχει η υπόθεση του Rutherford στηριζόμενοι στις αρχές τις κβαντικής μηχανικής. Αναφορές:
Comments are closed.
|


 RSS Feed
RSS Feed